Hypochlorige Säure: Stark oder schwach?
Einführung
Wenn wir an Säuren denken, stellen wir uns oft etwas vor, das Metall angreifen oder Hautverbrennungen verursachen kann. Aber was ist mit hypochloriger Säure (HClO)? Ist es stark oder schwach?
In diesem ausführlichen Artikel untersuchen wir die Eigenschaften von HClO, seine Vorteile, Anwendungen und wie es eine wichtige Rolle in unserem täglichen Leben spielt.
Tauchen Sie mit uns in die Chemie von HClO ein und finden Sie heraus, warum es unsere Aufmerksamkeit verdient.
Was ist Hypochlorige Säure?
Hypochlorige Säure ist eine einfache Verbindung, die entsteht, wenn sich Chlorgas in Wasser löst. Es spielt eine Schlüsselrolle bei verschiedenen Anwendungen, insbesondere bei der Hygiene und Desinfektion.
·Chemische Zusammensetzung: HClO besteht aus einem Wasserstoffatom, einem Chloratom und einem Sauerstoffatom.
·Bildung: HClO entsteht, wenn man Chlorgas mit Wasser mischt. Die Reaktion lässt sich wie folgt zusammenfassen:
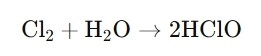
Dies zeigt, wie Chlor mit Wasser interagiert und unterchlorige Säure bildet.
Elektrolyse: Die Herstellung von Hypochloriger Säure
Eine der effizientesten Methoden zur Herstellung von unterchloriger Säure (HClO) ist die Elektrolyse. Bei diesem Prozess wird elektrischer Strom durch eine Salzwasserlösung geleitet, wodurch HClO und andere Nebenprodukte entstehen. Lassen Sie uns tiefer in die Funktionsweise und Bedeutung dieses Prozesses eintauchen.
Was ist Elektrolyse?
Elektrolyse ist ein chemischer Prozess, der elektrische Energie nutzt, um eine nicht spontane Reaktion anzutreiben. Bei der HClO-Produktion handelt es sich um die Elektrolyse einer Natriumchloridlösung (NaCl), allgemein bekannt als Kochsalzlösung.
Der Elektrolyseprozess
1.Vorbereitung der Lösung:
· Mischen Sie Wasser mit einer kleinen Menge Salz (Natriumchlorid). Dadurch entsteht eine Salzlösung, die Strom leitet.
2.Elektrolyse-Setup:
· Die Salzlösung wird in eine Elektrolysezelle gegeben, die zwei Elektroden enthält: eine Anode (positive Elektrode) und eine Kathode (negative Elektrode).
3.Anlegen von elektrischem Strom:
· Wenn elektrischer Strom angelegt wird, kommt es an den Elektroden zu einer Reihe elektrochemischer Reaktionen.
4.Chemische Reaktionen:
· An der Anode werden Chloridionen (Cl⁻) zu Chlorgas (Cl₂) oxidiert:
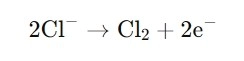
· An der Kathode wird Wasser reduziert, wodurch Wasserstoffgas (H₂) und Hydroxidionen (OH⁻) entstehen:
![]()
5.Bildung von hypochloriger Säure:
· Das an der Anode entstehende Chlorgas reagiert mit Wasser zu unterchloriger Säure:
![]()
· Die resultierende Lösung enthält HClO und andere Spezies, abhängig von den Bedingungen der Elektrolyse.
Vorteile der Elektrolyse für die HClO-Produktion
1.Erzeugung vor Ort:
· Die Elektrolyse ermöglicht die Produktion von HClO vor Ort, sorgt für Frische und reduziert den Lagerbedarf.
2.Anpassbare Konzentrationen:
· Benutzer können die HClO-Konzentration anpassen, indem sie die Salzkonzentration und die Dauer der Elektrolyse ändern.
3.Umweltfreundlich:
· Der Prozess erzeugt nur minimalen Abfall und die primären Nebenprodukte (Wasser und Salz) sind umweltfreundlich.
4.Kostengünstig:
· Die Herstellung von HClO durch Elektrolyse kann wirtschaftlicher sein als der Kauf vorgefertigter Lösungen, insbesondere bei großtechnischen Anwendungen.
Anwendungen von elektrolytischem HClO
Die durch Elektrolyse erzeugte unterchlorige Säure hat verschiedene Anwendungen und ist daher eine vielseitige Lösung in verschiedenen Branchen.
1.Gesundheitseinstellungen
In Krankenhäusern und Kliniken wird elektrolytisches HClO zur Desinfektion von Oberflächen und medizinischen Geräten eingesetzt. Seine Wirksamkeit gegen eine Vielzahl von Krankheitserregern hilft bei der Infektionskontrolle.
2.Lebensmittelindustrie
Lebensmittelverarbeitungsbetriebe nutzen elektrolytisches HClO zur Desinfektion von Geräten und Oberflächen und gewährleisten so die Lebensmittelsicherheit durch Minimierung der mikrobiellen Kontamination.
3.Wasseraufbereitung
Kommunale Wasseraufbereitungsanlagen nutzen durch Elektrolyse erzeugtes HClO, um Trink- und Abwasser zu desinfizieren und den Gemeinden sauberes Wasser zu liefern.
4.Haushaltsreinigung
Viele Haushaltsreiniger und Desinfektionsmittel enthalten mittlerweile elektrolytisches HClO und bieten so ein sicheres und wirksames Mittel zur Desinfektion von Oberflächen zu Hause.
Säure verstehen
Um festzustellen, ob HClO stark oder schwach ist, müssen wir das Konzept der Säure in der Chemie verstehen.
Die Definition von Säuren
In der Chemie werden Säuren durch ihre Fähigkeit definiert, Protonen (H⁺-Ionen) an andere Substanzen abzugeben.
·Brønsted-Lowry-Theorie: Nach dieser Theorie ist eine Säure jede Substanz, die ein Proton abgeben kann.
·Arrhenius-Theorie: Diese Theorie besagt, dass eine Säure eine Substanz ist, die die Konzentration von Wasserstoffionen in wässriger Lösung erhöht.
Anhand dieser Definitionen können wir das Verhalten von hypochloriger Säure beurteilen.
Ist HClO eine starke Säure?
Lassen Sie uns klären, was eine Säure stark oder schwach macht.
·Starke Säuren: Starke Säuren dissoziieren vollständig in Wasser. Das heißt, sie geben alle ihre Wasserstoffionen an die Lösung ab.
·HClO-Verhalten: Hypochlorige Säure dissoziiert in Wasser nur teilweise und setzt einige, aber nicht alle Wasserstoffionen frei. Infolge,wir klassifizieren es als schwache Säure.
Diese Unterscheidung ist von entscheidender Bedeutung, da die Stärke einer Säure ihre Reaktivität und Anwendungen beeinflusst.
Der pH-Wert von Hypochloriger Säure
Die pH-Skala misst, wie sauer oder alkalisch eine Lösung ist, und reicht von 0 (sehr sauer) bis 14 (sehr alkalisch).
·Typischer pH-Wert von HClO: Hypochlorige Säure hat normalerweise einen pH-Wert von etwa 5 bis 6,5, was auf eine leichte Säure hinweist.
Warum ist der pH-Wert wichtig?
Das Verständnis des pH-Werts von HClO hilft uns zu beurteilen, wie es in verschiedenen Umgebungen interagiert.
·Auswirkungen auf die Wirksamkeit: Die Wirksamkeit von HClO als Desinfektionsmittel nimmt in bestimmten pH-Bereichen zu. Beispielsweise verstärken niedrigere pH-Werte seine antimikrobiellen Eigenschaften.
·Anwendungen in der Wasseraufbereitung: Die Aufrechterhaltung des richtigen pH-Werts in Schwimmbädern stellt sicher, dass HClO weiterhin wirksam schädliche Mikroorganismen abtötet.
Vorteile von hypochloriger Säure
Was macht HClO besonders? Hier sind einige seiner wichtigsten Vorteile:
1.Wirksames Desinfektionsmittel: HClO ist für seine Fähigkeit bekannt, Bakterien und Viren abzutöten. Dies macht es zu einer beliebten Wahl für die Hygiene in verschiedenen Umgebungen.
2.Sicher im Gebrauch: Im Gegensatz zu stärkeren Säuren ist HClO sicher in der Handhabung und reizt die Haut nicht. Dies ist besonders wichtig im Gesundheitswesen.
3.Umweltfreundlich: HClO zerfällt in harmlose Substanzen und minimiert so seine Auswirkungen auf die Umwelt. Es zerfällt in Salz und Wasser, was es zu einer nachhaltigen Wahl macht.
4.Vielseitige Anwendungen: Von Haushaltsreinigern bis hin zur Wasseraufbereitung findet HClO in vielen Branchen Verwendung.
5.Ungiftig: Es stellt ein minimales Risiko für die menschliche Gesundheit dar und kann sicher in Bereichen der Lebensmittelzubereitung verwendet werden.
Wie funktioniert HClO?
Lassen Sie uns die Mechanismen hinter der Wirksamkeit von HClO als Desinfektionsmittel untersuchen.
Wirkmechanismus
·Penetration: HClO dringt in mikrobielle Zellen ein, schädigt deren Strukturen und tötet sie effektiv ab.
·Oxidativer Stress: HClO verursacht bei Bakterien und Viren oxidativen Stress, der zum Zelltod führt.
·Breitbandwirksamkeit: HClO ist wirksam gegen eine Vielzahl von Krankheitserregern, darunter Bakterien, Viren und Pilze. Diese Vielseitigkeit macht es für die Desinfektion von unschätzbarem Wert.
Die Hypochlorit-Ionen-Formel
Das Verständnis des Hypochlorition (ClO⁻) verbessert unser Verständnis von HClO.
·Konjugatbasis: Das Hypochlorition (ClO⁻) ist die konjugierte Base von HClO. Wenn HClO ein Proton abgibt, wird es zu ClO⁻.
·Rolle in der Chemie: Dieses Ion weist auch desinfizierende Eigenschaften auf, insbesondere bei der Wasseraufbereitung. Es wird häufig in Form von Natriumhypochlorit (NaClO) in Haushaltsbleichmitteln verwendet.
Stabilität von Hypochlorit-Ionen
·Stabilitätsfaktoren: Die Stabilität von ClO⁻ kann durch pH-Wert und Temperatur beeinflusst werden. Bei niedrigeren pH-Werten ist ClO⁻ stabiler und trägt zur Wirksamkeit von HClO als Desinfektionsmittel bei.
Praktische Anwendungen von Hypochloriger Säure
HClO findet Eingang in viele Produkte und Anwendungen. Hier sind einige häufige Verwendungszwecke:
1.Haushaltsreiniger: Viele Desinfektionsmittel und Desinfektionsmittel enthalten HClO aufgrund seiner starken antibakteriellen Eigenschaften.
2.Wasseraufbereitung: Es ist ein Grundnahrungsmittel, um Schwimmbäder sauber und sicher zum Schwimmen zu halten. HClO tötet wirksam schädliche Krankheitserreger ab, die im Poolwasser gedeihen.
3.Gesundheitspflege: HClO wird in der Wundversorgung und im chirurgischen Bereich eingesetzt und hilft aufgrund seiner antibakteriellen Eigenschaften, Infektionen vorzubeugen.
4.Lebensmittelindustrie: HClO wird häufig zur Desinfektion von Oberflächen und Geräten mit Lebensmittelkontakt verwendet, um die Lebensmittelsicherheit zu gewährleisten.
5.Landwirtschaft: Landwirte verwenden HClO, um Geräte zu desinfizieren und Krankheitserreger im Bewässerungswasser zu bekämpfen.
6.Veterinärmedizinische Versorgung: Es wird in der Tiergesundheit zur Desinfektion von Wunden und chirurgischen Instrumenten eingesetzt.
So erzeugen Sie hypochlorige Säure
Wir verlassen uns oft auf eineHOCl-Generatorfür eine effiziente HClO-Produktion. So funktioniert es:
1.Wasser und Salz mischen: Beginnen Sie mit der Kombination von Wasser und Salz. Diese Mischung ist für den Elektrolyseprozess unerlässlich.
2.Wenden Sie Elektrolyse an: Der Generator erzeugt elektrischen Strom, um HClO zu erzeugen. Dieser Prozess erleichtert die Reaktion zwischen Chlorionen und Wasser.
3.Bewahren Sie die Lösung auf: Sie können die generierte Lösung für die zukünftige Verwendung speichern. Sorgen Sie für angemessene Lagerbedingungen, um die Wirksamkeit aufrechtzuerhalten.
Vorteile der Verwendung eines HOCl-Generators
·Produktion vor Ort: Die Erzeugung von HClO vor Ort sorgt für Frische und Wirksamkeit und reduziert den Bedarf an Transport und Lagerung.
·Kostengünstig: Die Herstellung von HClO mit einem Generator kann wirtschaftlicher sein als der Kauf vorgefertigter Lösungen.
·Benutzerdefinierte Konzentrationen: Benutzer können die HClO-Konzentration je nach Bedarf anpassen, wodurch sie für verschiedene Anwendungen vielseitig einsetzbar ist.
Vergleich von hypochloriger Säure mit anderen Säuren
Wie schlägt sich HClO im Vergleich zu anderen Säuren?
Im Vergleich zu starken Säuren
·Sicherheit: Im Gegensatz zu starken Säuren wie Salzsäure (HCl) stellt HClO ein geringeres Risiko für die menschliche Gesundheit und Sicherheit dar.
·Vielseitigkeit: HClO eignet sich für den Einsatz in sensiblen Umgebungen wie der Lebensmittelzubereitung und dem Gesundheitswesen.
Im Vergleich zu anderen schwachen Säuren
·Wirksamkeit: HClO übertrifft einige schwache Säuren in der antimikrobiellen Wirksamkeit. Beispielsweise hat Essigsäure (Essig) im Vergleich zu HClO eine schwächere Desinfektionskraft.
Die Bedeutung der richtigen Verwendung
Die richtige Verwendung von HClO maximiert seine Vorteile. Hier einige Tipps:
1.Befolgen Sie die Richtlinien: Aus Sicherheitsgründen immer die empfohlenen Konzentrationen einhalten. Übermäßiger oder falscher Gebrauch kann zu einer unwirksamen Desinfektion führen.
2.Überwachen Sie den pH-Wert: Wenn der pH-Wert im optimalen Bereich gehalten wird, bleibt HClO wirksam. Regelmäßige Tests können helfen, den gewünschten pH-Wert aufrechtzuerhalten.
3.Richtig lagern: Lagern Sie HClO an dunklen, kühlen Orten, um die Stabilität zu gewährleisten. Die Einwirkung von Licht und Hitze kann seine Wirksamkeit beeinträchtigen.
Mythen über hypochlorige Säure entlarven
Es gibt viele Missverständnisse über HClO. Lassen Sie uns einige davon ansprechen:
·Mythos 1: HClO ist gefährlich.
·Tatsache: HClO ist sicherer als viele starke Säuren und hat ein geringes Reizpotenzial.
·Mythos 2: Alle Desinfektionsmittel sind gleich.
·Tatsache: HClO ist aufgrund seines Wirksamkeits- und Sicherheitsprofils einzigartig.
·Mythos 3: HClO hat einen starken Geruch.
·Tatsache: Hypochlorige Säure hat im Vergleich zu Chlorgas einen milden Geruch, was die Anwendung angenehmer macht.
Beispiele aus der Praxis für die Verwendung von HClO
Im Gesundheitswesen
Krankenhäuser und Kliniken nutzen HClO zur Desinfektion von Oberflächen und Instrumenten. Es hilft, gesundheitsbedingte Infektionen zu verhindern und schützt Patienten und Personal gleichermaßen.
In der Lebensmittelverarbeitung
Lebensmittelhersteller verwenden HClO zur Desinfektion von Geräten und Oberflächen. Diese Praxis trägt zur Gewährleistung der Lebensmittelsicherheit bei und verlängert die Haltbarkeit durch Reduzierung der mikrobiellen Kontamination.
In Wasseraufbereitungsanlagen
Kommunale Wasseraufbereitungsanlagen verwenden häufig HClO zur Desinfektion.
Referenzen
1.Zentren für die Kontrolle und Prävention von Krankheiten (CDC)- Desinfizieren mit Hypochloriger Säure.CDC-Leitfaden für hypochlorige Säure
2.Zeitschrift für Umweltwissenschaften und Gesundheit- Die Rolle von HClO bei der Wasseraufbereitung. Zeitschrift für Umweltwissenschaften
3.Chemie LibreTexts- Säurestärke und Dissoziation. LibreTexts Chemie
4.Umweltschutzbehörde (EPA)- Ein Leitfaden zur Chlorierung und unterchloriger Säure.EPA-Richtlinien
5.Weltgesundheitsorganisation (WHO)- Wasser, Sanitäranlagen und Hygiene: Richtlinien zur Desinfektion.Desinfektionsrichtlinien der WHO
6.Internationale Zeitschrift für Umweltforschung und öffentliche Gesundheit- Sicherheit und Wirksamkeit von Hypochloriger Säure. IJERPH
7.American Journal of Infection Control- Die antimikrobiellen Eigenschaften von hypochloriger Säure.AJIC
8.Zeitschrift für Lebensmittelschutz- Verwendung von Hypochloriger Säure in der Lebensmittelsicherheit. Zeitschrift für Lebensmittelschutz
9.Zeitschrift für Krankenhausinfektionen- Hypochlorige Säure als Desinfektionsmittel im Gesundheitswesen.Zeitschrift für Krankenhausinfektionen
10.Lebensmittel- und chemische Toxikologie- Toxikologie der hypochlorigen Säure und ihre Anwendungen. Lebensmittel- und chemische Toxikologie
